


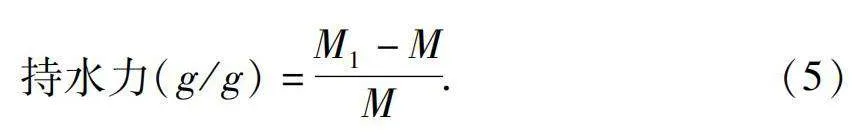

摘 要:【目的】研究新疆阿克苏地区野生牛肝菌分类地位,分析其营养成分组成和解析主要多糖功能结构,为野生牛肝菌多糖的深入开发及利用提供科学参考。【方法】利用形态学和分子生物学手段对野生牛肝菌进行鉴定,分析牛肝菌中的营养成分和矿物质进行检测。采用水提醇沉法提取皱皮疣柄牛肝菌粗多糖,并利用DEAE-52纤维素柱层析进行纯化,利用高压液压色谱分析其单糖组成。【结果】阿克苏地区野生牛肝菌归属为伞菌目,牛肝菌科,疣柄牛肝菌属,分子鉴定为皱皮疣柄牛肝菌(Leccinum duriusculum)。其主要的营养物质为糖类和蛋白质,分别占57.57%和27.32%。通过柱层析联合中压色谱系统分离的手段获得了三种多糖组分为LD-1、LD-2和LD-3,其中LD-1的提取率最高,为78.8%,有较强的水溶性,红外光谱表明其含有糖类化合物,葡萄糖占比最高。【结论】阿克苏地区野生牛肝菌富含多糖,持水力强。
关键词:牛肝菌;营养成分;矿物质;多糖;分离纯化
中图分类号:S646 文献标志码:A 文章编号:1001-4330(2024)10-2557-09
收稿日期(Received):2024-03-11
基金项目:第三次新疆综合科学考察子课题(2022xjkk1200);新疆农业科学院农业科技创新稳定支持专项(xjnkywdzc-2022005-6);新疆农业科学院农业科技创新平台能力提升建设专项(nkypt005);新疆农业科学院自主培育项目团队建设专项(nkyzztd-001)
作者简介:张芯语(1999-),女,河南人,硕士研究生,研究方向食品加工与安全,(E-mail)1807835109@qq.com
通讯作者:张志东(1977-),男,新疆人,研究员,博士,硕士生导师,研究方向为特殊环境微生物及益生菌资源,(E-mail)zhangzheedong@sohu.com
0 引 言
【研究意义】牛肝菌隶属于担子菌门(Basidiomycota)蘑菇纲(Agaricomycetes)牛肝菌目(Boletales),其具有重要的生态和经济价值[1]。目前,我国发现的牛肝菌种类多达390种以上,其中近200种可食用,如美味牛肝菌(Boletus edulis)、铜色牛肝菌(B.aereus)、橙香牛肝菌(B.citrifragrans)、褐圆孔牛肝菌(Gyroporuscastaneus)、蓝圆孔牛肝菌(Gcyanescens)、橙黄疣柄牛肝菌(Leccinum aurantiacum)、黄皮疣柄牛肝菌(L.crocipodium)和褐环乳牛肝菌(Suillus luteus)等均具有美味可食,营养丰富,富含钙、铁等人体所必需的矿物质元素等特点[2,3]。新疆阿克苏地区,是典型的绿洲农业区,每年7~9月,该地区部分区域的杨树林下野生牛肝菌子实体成熟,少数牛肝菌因有毒或味苦而不能食用。因此,加强野生牛肝菌的鉴别对于强化食品安全有着重要的意义。【前人研究进展】贾莉等[4]阐述了阿克苏地区杨树林下牛肝菌的产业价值,指出了野生资源过度采摘、人工培育难等问题。牛肝菌多糖含量较高,具有抗氧化、抗疲劳、免疫调节等作用[5,6]。郑俏然等[7]表明一定剂量的美味牛肝菌多糖能减轻CCl4引起的小鼠肝损伤,提高肝脏抗氧化能力。郑金玲[8]研究表明铜色牛肝菌多糖可有效抑制S180实体瘤的生长并保护免疫器官。【本研究切入点】有关阿克苏地区野生牛肝菌的分类鉴定和功能活性鲜有报道,其多糖的提取、纯化及结构尚不清晰,有待深入研究。需分析阿克苏地区野生牛肝菌营养成分测定及其多糖的结构分析。【拟解决的关键问题】分析野生牛肝菌的主要营养成分和矿物质元素,以及其多糖的结构,研究阿克苏地区野生牛肝菌中营养成分及矿质元素的含量水平,为有效保护其野生资源、实现人工驯化栽培以及对野生牛肝菌的食品质量控制提供科学依据。
1 材料与方法
1.1 材 料
野生牛肝菌采自阿克苏地区拜城县赛里木镇(82°11′55″E,41°47′10″N)。新鲜牛肝菌子实体经清洗后切片,80 ℃烘干6 h,粉碎,过60目筛,备用。
1.2 方 法
1.2.1 牛肝菌的鉴定
1.2.1.1 形态学
根据牛肝菌的生长条件、外观等初步鉴定形态特征。
1.2.1.2 分子生物学
(1)总DNA提取及其浓度检测
将新鲜牛肝菌子实体清洗干净后,烘干切片,粉碎保存。按照Ezup柱式真菌基因组DNA抽提试剂盒说明书提取总DNA,超微量微孔板检测DNA浓度与纯度,于-20 ℃保存备用。
(2)PCR扩增及测序
ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)通用引物进行PCR扩增。PCR反应体系为50 μL(2×Taq Mix 25 μL,DNA模板、ITS1、ITS4各1 μL,ddH2O 22 μL)。PCR扩增条件:94 ℃ 5 min;94 ℃ 45 s,55 ℃ 30 s,72 ℃ 10 s,30个循环;72 ℃ 10 min。取10 μL反应液用1%琼脂糖凝胶进行电泳检测。将PCR产物送至生工生物工程(上海)股份有限公司测序,测序结果在NCBI进行序列相似性比对分析,利用MEGA11.0软件对扩增片段序列和部分已知的真菌DNA序列做进化树分析。
(3)营养成分
总糖含量的测定按照GB/T15672-2009测定;粗蛋白含量的测定按照GB5009.5-2016测定;粗灰分含量的测定按照GB5009.4-2016测定;牛肝菌中矿物质元素含量的测定分别采用:磷-GB5009.87-2016、锰-GB5009.242-2017、钙-GB5009.92-2016、铁-GB5009.90-2016、铜-GB5009.13-2017、锌-GB5009.14-2017、钠-GB9009.91-2017、钾-GB9009.91-2017。
1.2.1.3 牛肝菌粗多糖的提取
称取牛肝菌子实体粉末,水为提取液,按料液比1:20,80 ℃下提取2 h后,8 000 r/min,离心5 min,收集上清液,加入无水乙醇至终浓度为80%,4 ℃静置过夜,以6 000 r/min,离心5 min,收集沉淀,并将沉淀用80%乙醇洗涤2次;在-80 ℃下冷冻干燥,得到牛肝菌粗多糖[9,10]。
多糖提取率(%)=(多糖质量/菌粉质量)×100%.(1)
1.2.1.4 粗多糖脱蛋白
将粗多糖复溶,配制成浓度为5 mg/mL的多糖溶液,按溶液体积的1/4加入Sevage试剂(正丁醇∶氯仿=1∶4),磁力搅拌20 min,离心(4 000 r/min,5 min)后除去下层有机试剂和中间层的蛋白,此过程重复操作3次。多糖溶液中加入终浓度为80%的乙醇,4 ℃静置过夜,沉淀冷冻干燥得粗多糖,备用[11]。
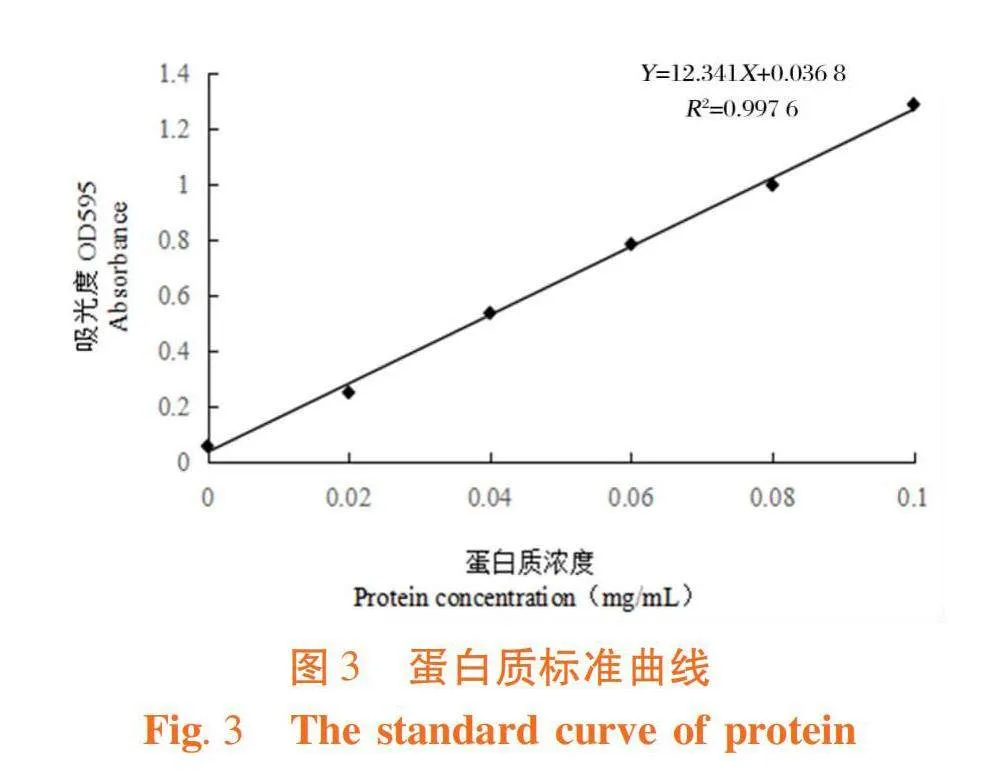
1.2.1.5 蛋白质标准曲线的制作
考马斯亮蓝G250的配制:称取0.1 g的考马斯亮蓝G250染色剂,将其溶解于5 mL 95%的乙醇溶液中,加入10 mL 85%磷酸溶液,蒸馏水定容至100 mL,滤纸过滤备用。
牛血清蛋白标准溶液的配制(0.1 mg/mL):吸取标准牛血清蛋白溶液(0.2、0.4、0.6、0.8和1.0 mL)于10 mL试管中,并补水至1 mL,再分别加入考马斯亮蓝染色液,于室温下静置10 min,于595 nm处检测吸光值,并绘制标准曲线。
蛋白质脱除率(%)=(A1-A0)/A1×100%.(2)
式中,A1:未除蛋白时粗多糖溶液中蛋白质的含量;A0:除蛋白后粗多糖溶液中蛋白质的含量。
多糖回收率(%)=(A0/A1)×100%.(3)
式中,A0:脱蛋白后的多糖含量;A1:脱蛋白前的多糖含量。
1.2.1.6 小分子杂质的透析
采用透析法去除小分子物质,该方法主要分为三个步骤:第一步收集洗脱液,浓缩;第二步使用透析袋进行透析(截留分子量为7 000 D[12],透析袋预先100 ℃煮沸10 min),用纯净水透析24 h,并保证每隔8 h彻底更换一次纯净水;第三步将透析后的牛肝菌多糖溶液进行干燥处理,得到多糖粉末。
1.2.1.7 DEAE-52纤维素柱层析
参照文献方法[13],对DEAE-52纤维素进前处理:用蒸馏水充分搅拌均匀,浸泡24 h后抽滤,再用0.5 mol/L的NaOH溶液浸泡2 h,每隔15 min搅拌一次。再次抽滤,蒸馏水洗至中性,用0.5 mol/L HCl溶液浸泡2 h,抽滤,蒸溜水洗至中性,最后再用0.5 mol/L的NaOH溶液浸泡2 h,蒸馏水洗至中性,将纤维素装入盛有蒸馏水的烧杯中备用。
装柱与平衡:①装柱:采用湿法装柱,用蒸馏水将层析柱清洗干净,活化好的柱材料搅拌均匀后,缓慢倒入层析柱,使柱材料自然沉降。②平衡:平衡的缓冲液选用蒸馏水或实验所用的洗脱溶液,控制流速为1 mL/min。
1.2.1.8 水溶性和持水力
(1)水溶性测定
参照文献方法[14],准确称取0.2 g不同组分粗多糖样品,置于50 mL的烧杯中,再加入20 mL的去离子水,90 ℃连续搅拌水浴30 min,水浴结束后,6 000 r/min,离心10 min,取上清液,于105℃烘干至恒重,记录质量,计算多糖的水溶性。
水溶性(%)=M0M×100%. (4)
式中,M0表示烘干后固体的质量,M表示样品质量。
(2)持水力(WHC)测定
参照文献方法[15]略做修改,准确称取0.2 g不同组分多糖样品,于50 mL的离心管中,加入40 mL的蒸馏水,振荡摇匀后室温静置24 h,转速6 000 r/min,离心10 min,去除上清液,并使用滤纸吸取沉淀中的剩余水分,称量沉淀重量并作记录。
持水力(g/g)=M1-MM.(5)
式中,M1表示样品恒重后的质量,M表示样品质量。
1.2.1.9 紫外光谱扫描
将洗脱得到的3种多糖样品(LD-1,LD-2和LD-3)配制成质量浓度为5 mg/mL的待测溶液,将配制后的溶液置于石英比色皿中,进行200~800 nm紫外区全波长扫描,记录分析3种多糖样品的紫外光谱图,并观察各样品在260 nm和280 nm处的吸收峰情况。
1.2.1.10 红外光谱扫描
取5 mg醇沉多糖与溴化钾粉末混合碾磨后,制片压片,在波数4 000~400 cm-1内进行光谱扫描,组合均在4 000~400 cm-1出现吸收峰[16,17],分析比较不同样品的红外光谱图。
1.2.1.11 单糖组成
参照文献方法[18]略修改多糖水解及柱前衍化:取10 mg多糖样品于梨形瓶中,加入2 mL 2 mol/L H2SO4,充入N2并在油浴锅里100 ℃水解8 h,水解结束后用0.3 mol/L NaOH中和至中性,离心取上清液200 μL,依次加入100 μL 0.5 mol/L PMP(1-苯基-3-甲基-5-吡唑啉酮)甲醇溶液和100 μL 0.3 mol/L NaOH,70 ℃水浴60 min,冷却后加入100 μL 0.3 mol/L的HCl,混匀后加入1 mL CCl3萃取,离心取上清。重复3次,过0.22 μm水相滤膜备用。标准品同法处理。
色谱条件:采用高效液相色谱法分析LD-1的单糖组成,流动相为0.05 mol/L V(磷酸盐)∶V(乙腈)=82∶12,流速为1.0 mL/min,检测波长为250 nm,柱温为30 ℃。
1.3 数据处理
使用Excel 2019整理数据,用SPSS 25对试验数据进行分析。
2 结果与分析
2.1 形态特征描述
研究表明,牛肝菌子实体大部分生长于白杨林中,多发生在树坑、草坑相应的阴凉处。当地采摘的子实体直径在1~20 cm不等。成熟牛肝菌的菌盖直径大约为5~9 cm,初期球形菌盖紧包菌柄顶端,不同的生长环境条件下,表面也存在一定差异性。有些光滑平整,有些凹凸不平,后期因干旱,菌盖表面多呈龟裂状。菌肉白色,菌柄顶部表现为白色,菌管变褐色,与该种野生牛肝菌最近似的为伞菌目(Agaricales)的皱皮疣柄牛肝菌(Leccinum duriusculum)。图1
2.2 牛肝菌的分子鉴定
研究表明,样品与NCBI登录号为AF484445(Leccinum duriusculum)的序列的亲缘关系最近,相似性达到100%,将其鉴定为皱皮疣柄牛肝菌(Leccinum duriusculum),为伞菌目(Agaricales),牛肝菌科(Boletaceae),疣柄牛肝菌属(Leccinum Qray)。图2
2.3 营养成分测定
研究表明,试验中牛肝菌的总糖含量为57.57%,蛋白质含量为27.32%,灰分为11.02%,每1 000 g样品中,钙含量最高(670 mg/kg),其次是铁(434 mg/kg)、磷(332 mg/kg)、钾(142 mg/kg)、钠(137 mg/kg)、锌(85 mg/kg)、铜(48 mg/kg),含量最低的是锰(12 mg/kg)。
2.4 粗多糖脱蛋白
研究表明,采用线性拟合回归方程进行求解。经计算,3次脱蛋白后粗多糖中蛋白质的脱除率为4.44%,多糖回收89.5%。图3
2.5 DEAE-52纤维素柱层析
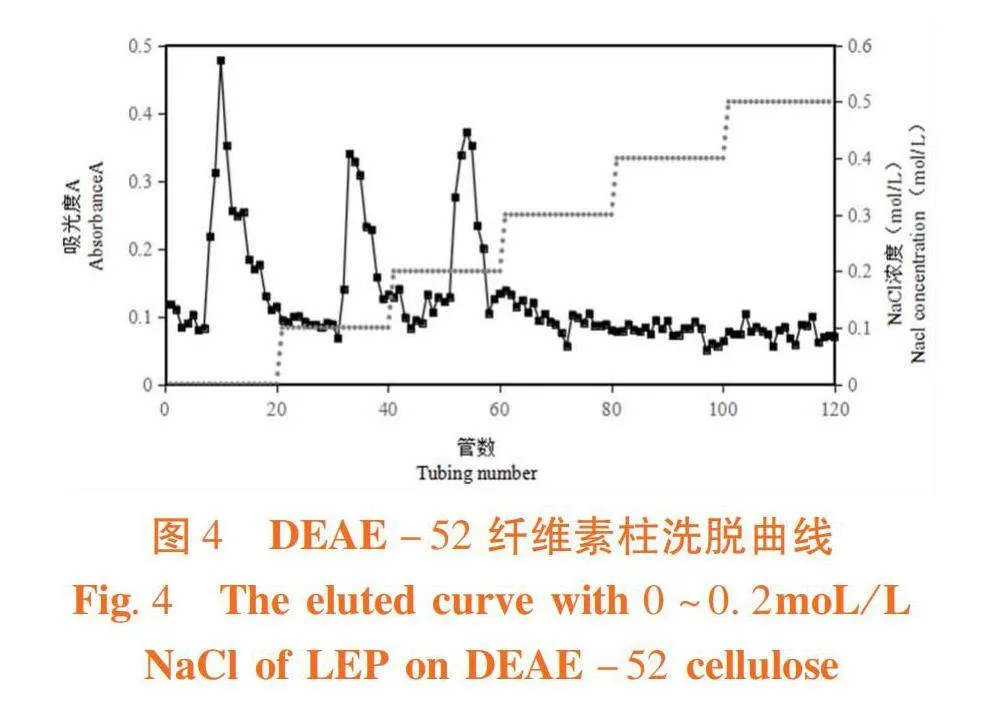
研究表明,分别收集水洗脱部分LD-1,0.1 mol/L NaCl洗脱部分LD-2,0.2 mol/L NaCl洗脱部分LD-3,提取率分别为78.8%、12.65%和8.55%。LD为棕色的粉末状,LD-1为纯白色絮状,LD-2和LD-3均为淡黄色絮状物。图4,图5
2.6 不同多糖组合的水合性质
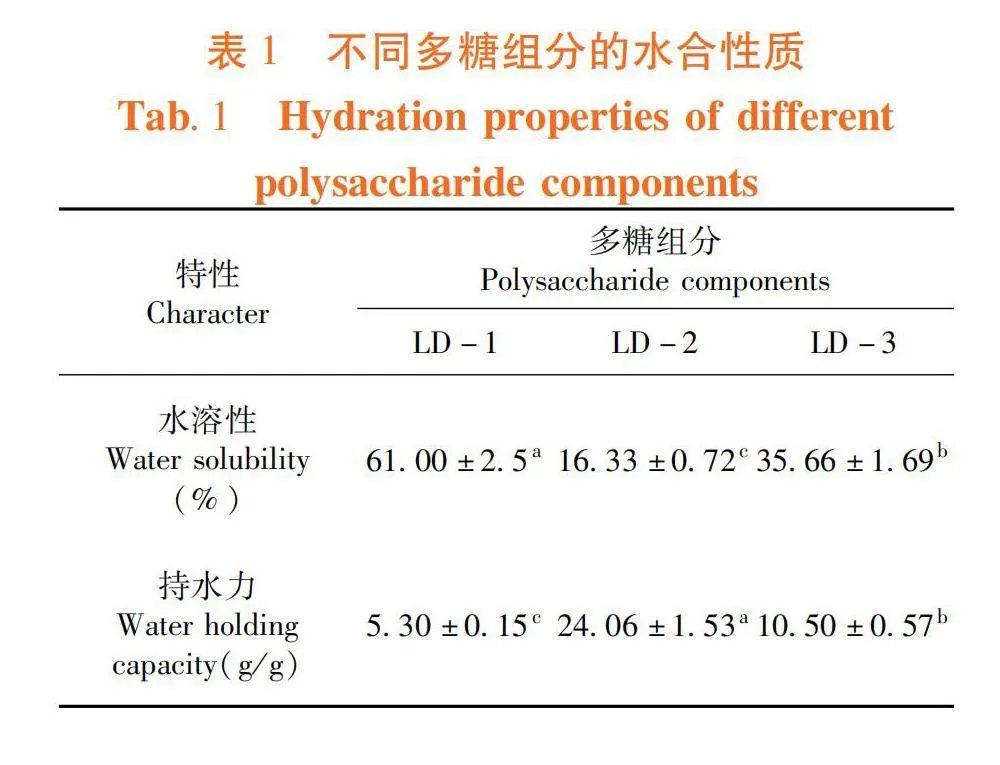
研究表明,LD-1水溶性较强,LD-3次之,LD-2水溶性最弱,且LD-2持水力最大。表1
2.7 紫外光谱扫描
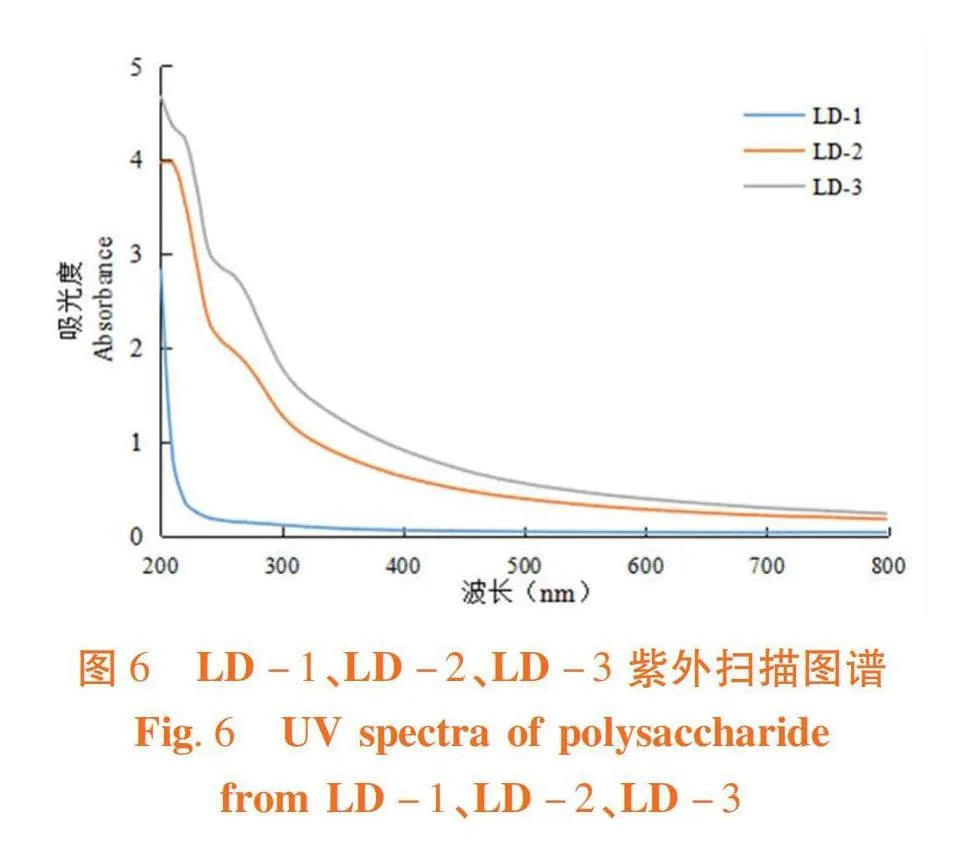
研究表明,3个组分所对应的曲线在波长260 nm和280 nm处平缓光滑,无吸收峰出现,LD-1、LD-2和LD-3中不存在游离的核酸及蛋白质等杂质。图6
2.8 红外光谱扫描
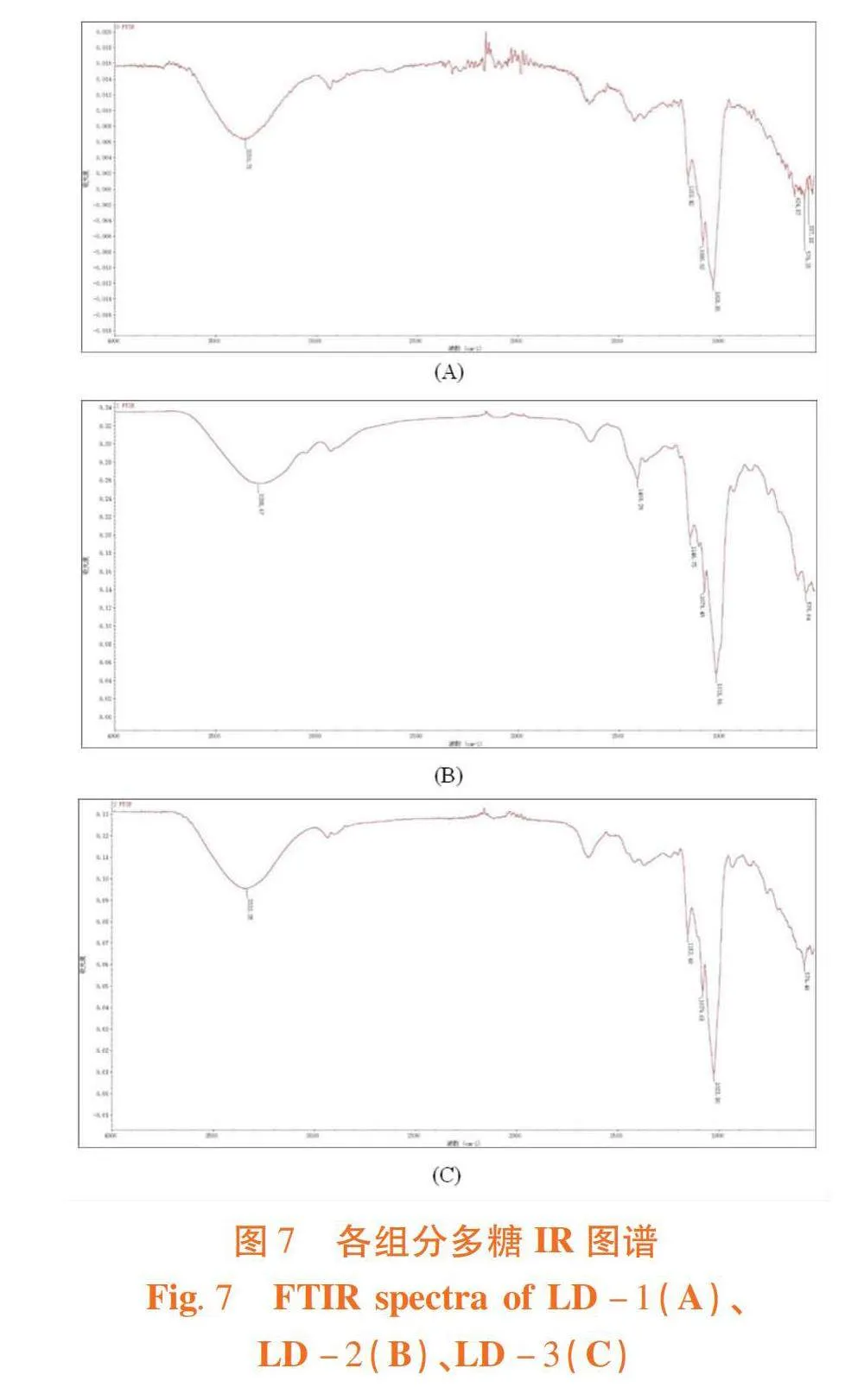
研究表明,3 288、3 332和3 350 cm-1波数处的宽的吸收峰为O-H的伸缩振动引起的,说明三种多糖组分中均存在分子内和分子间氢键,1 409 cm-1波数处是由C-H的变角振动引起的,这组峰是糖类的特征吸收峰;1 018、1 023、1 028、1 076、1 080、1 146、1 152、1 153和1 179 cm-1波数处的吸收峰与吡喃环的醚键C-O-C的伸缩振动有关,在此区域(1 200~1 000 cm-1)内为多糖的分子指纹区,3个组分均为吡喃糖。图7
2.9 LD-1单糖组分
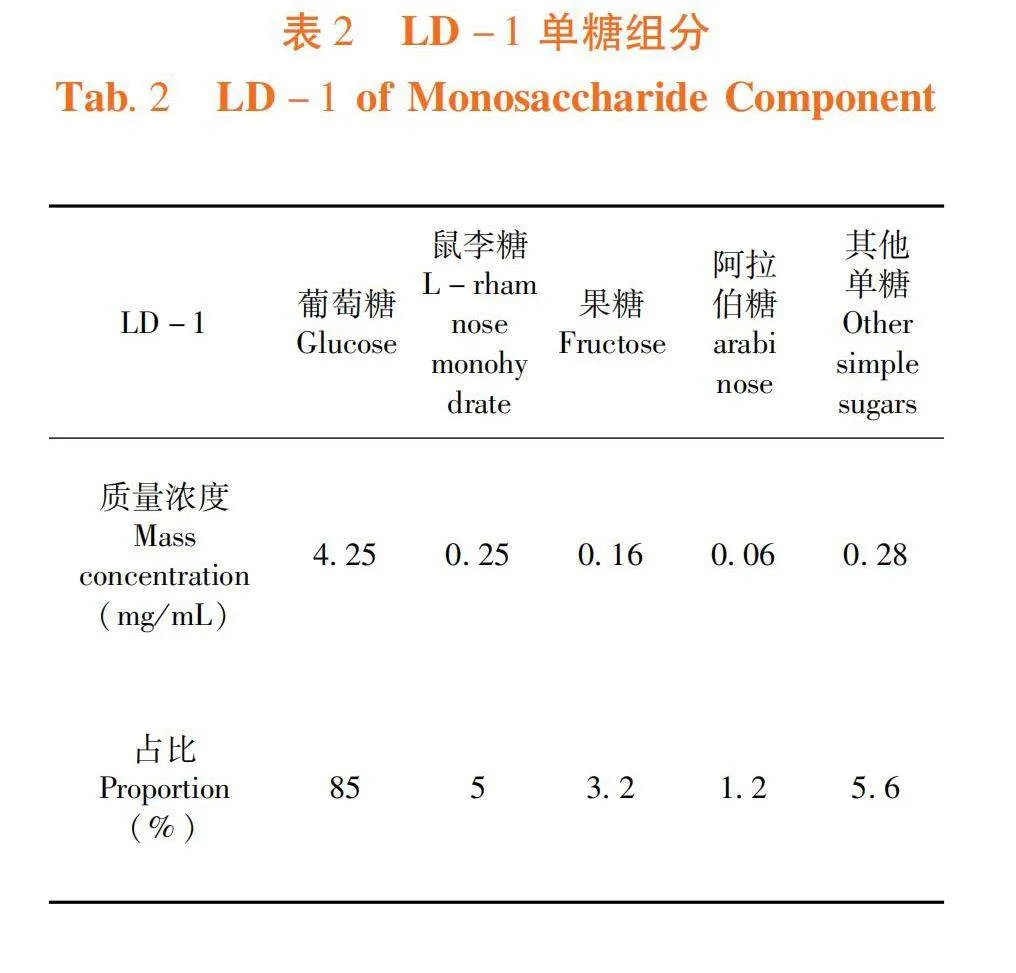
研究表明,LD-1中单糖组分为葡萄糖、鼠李糖、果糖、阿拉伯糖,其中含量最高的是葡萄糖,占比85%。表2
3 讨 论
3.1 目前新疆地区已报道的牛肝菌主要有亚洲小牛肝菌、褐盖牛肝菌、美味牛肝菌、红脚牛肝菌、坚实牛肝菌、火红牛肝菌、褐黄牛肝菌、小橙黄牛肝菌、灰疣柄牛肝菌、褐疣柄牛肝菌和亚疣柄牛肝菌等[19]。新疆阿克苏地区拥有良好的生态环境和丰富的森林资源基础,然而,有关该地区野生牛肝菌的分类鉴定鲜有报道。目前,皱皮疣柄牛肝菌在我国分布主要有西藏及新疆额尔齐斯河沿岸,该菌属树木的外生菌根菌;其子实体受外界环境影响较大,在雨后气温偏低、适宜的散射光照、湿度较大时发生,子实体生长快,个体较大,菌肉较松软,菌盖表面少有龟裂,而在沙漠绿洲等较干旱的环境下,子实体生长缓慢,个体小,菌肉紧密硬实,菌盖表面常龟裂[20,21]。皱皮疣柄牛肝菌与皱盖疣柄牛肝菌极为相似,但皱盖疣柄牛肝菌,菌盖多有皱缩;皱皮疣柄牛肝菌菌盖则没有皱缩,似有刻纹状凸起,后期变至平滑。
3.2 野生牛肝菌富含多糖和蛋白质,并含有多种人体所需的矿物质,但含量随着产地不同有所差异。马长中等[22]分别对产自百巴和林芝觉木的橙黄疣柄牛肝菌营养组成进行了分析,其粗蛋白含量为19.77%和21.17%,总糖含量为9.02%和10.11%,粗脂肪含量为4.42%和4.67%,且富含矿物元素,其中K含量最高,其次是Na和Ca;刘秋鸣等[23]测定了采自云南省的25个产地的黄皮疣柄牛肝菌,其粗蛋白含量为24.54%~37.25%,粗脂肪含量为0.88%~3.78%,可溶性总糖含量为7.03%~19.03%;张春霞等[24]测定了暗褐网柄牛肝菌子实体的总糖和蛋白质的含量分别为2.64%和23.3%,发现其Fe、P和K的含量相对较高。研究检测的阿克苏野生皱皮疣柄牛肝菌中总糖含量为57%,蛋白质含量为27%,其矿物质中Ca含量最高,其次是Fe和P。与其他牛肝菌相比,其总糖含量是橙黄疣柄牛肝菌的5倍、是暗褐网柄牛肝菌的20倍;蛋白质含量与黄皮疣柄牛肝菌含量相当,略高于橙黄疣柄牛肝菌和暗褐网柄牛肝菌;在矿物质元素中Ca、Fe含量是白牛肝菌和黑牛肝菌的60倍[25],Mn的含量仅次于黑牛肝菌,表明该地区野生皱皮疣柄牛肝菌是一种富含糖分、蛋白质、高矿物质的野生食用菌。
3.3 牛肝菌多糖具有多种生物活性,而有关皱皮疣柄牛肝菌子实体多糖的功能活性和组成相关研究极为有限。前期研究发现,阿克苏野生皱皮疣柄牛肝菌粗多糖具有较好的抗氧化能力,其抗氧化活性与多糖的浓度成正相关,不同提取方法下,当粗多糖LD-80浓度达到10 mg/mL时,其清除DPPH和OH-自由基能力也达到48%和52%,与已报道的皱盖疣柄牛肝菌多糖[26]抗氧化能力相当。现有研究表明,不同种属牛肝菌多糖其单糖组成往往存在差异,伍燕等[27]通过提取和精制皱盖疣柄牛肝菌多糖,获得LRP-Ⅰ和LRP-Ⅱ两个组分,其LRP-Ⅰ单糖组成为甘露糖、鼠李糖、葡萄糖、木糖和岩藻糖,LRP-Ⅱ单糖组成为甘露糖、葡萄糖、木糖、阿拉伯糖和岩藻糖。樊莹润等发现黄皮疣柄牛肝菌多糖的单糖组成为甘露糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖、木糖、岩藻糖。试验研究通过对粗多糖的纯化,获得了LD-1、LD-2和LD-3等三个多糖组分,其中LD-1占比最高,约为粗多糖的78.8%;通过单糖组成测定,LD-1中单糖为葡萄糖、鼠李糖、果糖、阿拉伯糖,其中葡萄糖占比最高,为85%,与相关疣柄牛肝菌多糖的单糖组成存在明显差异。
4 结 论
阿克苏野生牛肝菌鉴定为皱皮疣柄牛肝菌(Leccinum duriusculum),为伞菌目(Agaricales),牛肝菌科(Boletaceae),疣柄牛肝菌属(Leccinum Qray)。该牛肝菌营养物质丰富,其主要的营养物质为糖类和蛋白质,分别占57.57%和27.32%,并富含有钙、铁、磷、钾、钠、锌、铜和锰等矿物质元素。组分为LD-1、LD-2和LD-3,其中LD-1提取率最高,为78.8%,测定了LD-1中单糖组成为葡萄糖、鼠李糖、果糖和阿拉伯糖,其中占比最高的是葡萄糖。
参考文献(References)
[1]ZHANG L, HU Y, DUAN X Y, et al. Characterization and antioxidant activities of polysaccharides from thirteen boletus mushrooms [J].International Journal of Biological Macromolecules, 2018, 113: 0141-8130.
[2]李泰辉, 宋斌. 中国食用牛肝菌的种类及其分布[J].食用菌学报, 2002, (2): 22-30.
LI Taihui, SONG Bin. The Species and Distribution of Edible Boletus in China[J].Acta Edulis Fungi, 2002, (2): 22-30.
[3]彭秋菊, 严江, 陈国平, 等. 牛肝菌挥发性风味物质的研究进展[J].食品科技, 2022, 47(6): 127-132,139.
PENG Qiujiu, YAN Jiang, CHEN Guoping, et al. Research on Volatile Flavor Compounds of Boletus[J].Food Technology, 2022, 47(6): 127-132,139.
[4]贾莉, 刘江华. 阿克苏地区林下经济发展现状与前景—以皱盖疣柄牛肝菌为例[J].林业科技通讯, 2023, (3): 1-5.
JIA Li, LIU Jianghua. Current situation and prospect of economic development in the understory of Aksu area: A case study of Leccinum rugosiceps[J].Forest Science and Technology, 2023, (3): 1-5.
[5]樊莹润, 郑婷婷, 李泽林, 等. 黄皮疣柄牛肝菌多糖结构鉴定及对小鼠盲肠与粪便中短链脂肪酸的影响[J].食品科学, 2022, 43(11): 130-136.
FAN Yingrun, ZHENG Tingting, LI Zelin, et.al. Structural Identication of Leccinum crocipodium (Letellier.) Watliag Polysaccharide and Its Effect on Short Chain Fatty Acid Contents in Cecum Contents and Feces of Mice[J].Food Science, 2022, 43(11): 130-136.
[6]郑金玲. 铜色牛肝菌多糖的制备及其小鼠体内抗肿瘤活性的研究[D].昆明: 昆明理工大学, 2022.
Jinling Zheng. Preparation of Boletus aereus polysaccharides and their anti-tumor activity in mice[D].Kunming: Kunming University of Science and Technology, 2022.
[7]郑俏然, 张恒, 李文峰, 等. 美味牛肝菌多糖对急性肝损伤小鼠的保肝作用[J].食品与机械, 2019, 35(12): 141-145.
ZHENG Qiaoran, ZHANG Heng, LI Wenfeng, et.al. Protective effect of polysaccharides from delicious Boletus edulis on acute liver injury in mice[J].Food and Machinery, 2019, 35(12): 141-145.
[8]ZHENG J L, ZHANG T T, FAN J, et.al. Protective effects of a polysaccharide from Boletus aereus on S180 tumor-bearing mice and its structural characteristics [J].International journal of biological macromolecules, 2021, 188: 0141-8130.
[9]Yu S S, Ma R J, Dong X D, et.al. A novel polysaccharide from Boletus edulis: Extraction, purification, characterization and immunologic activity [J].Industrial Crops and Products, 2022, 186: 0926-6690.
[10]郑婷婷, 严亮, 张文杰, 等. 水碱连续提取黄皮疣柄牛肝菌粗多糖的理化性质及抗氧化活性研究[J].食品工业科技, 2020, 41(15): 84-89.
ZHENG Tingting, YAN Liang, ZHANG Wenjie, et.al. Physicochemical Properties and Antioxidant Activity of Water-Alkali Continuous Extraction of Crude Polysaccharides from Leccinellum crocipodium(Letellier.)Watliag[J].Science and Technology of Food Industry, 2020, 41(15): 84-89.
[11]DU R P, XING H W, YANG Y P, et.al. Optimization, purification and structural characterization of a dextran produced by L. mesenteroides isolated from Chinese sauerkraut [J].Carbohydrate polymers, 2017, 174: 409-416.
[12]粟思源. 美网柄牛肝菌的鉴定及其多糖(BRS-X)的结构鉴定、免疫活性及抗肿瘤活性机制的研究[D].南充: 西华师范大学, 2019.
Siyuan SU. Identification of Boletus edulis and its polysaccharide (BRS-X) structure, immune activity, and anti-tumor activity mechanism[D].Nanchong: China West Normal University, 2019.
[13]曾丽萍, 王心诗, 吴素蕊, 等. 云南铜色牛肝菌多糖分离纯化及抗氧化活性研究[J].食品工业科技, 2016, 37(4): 151-154.
ZENG Liping, WANG Xinshi, WU Surui, et.al. Purification and antioxidant activity of polysaccharide from Boletus aereus in Yunnan[J].Science and Technology of Food Industry, 2016, 37(4): 151-154.
[14]赵圆圆. 杏鲍菇子实体多糖的提取纯化、结构表征及降脂活性研究[D].西安: 陕西科技大学, 2020.
Yuanyuan ZHAO. Study on Extraction, Purification, Structure Characterization and Lipid-lowering Activity of Polysaccharide from Pleurotus eryngi Fruit Body[D].Shaanxi: Shaanxi University of Science Technology, 2020.
[15]程毛, 邢莉丽, 江吉德. 不同干燥方式对柚子皮多糖理化特性及功能活性的影响[J].食品科技, 2021, 46(4): 162-167.
CHENG Mao, XING Lili, JIANG Jide. Effects of Different Drying Methods on the Physicochemical Properties and Functional Activities of Polysaccharides from Grapefruit Peel[J].Food Science and Technology, 2021, 46(4): 162-167.
[16]陈超. 榛蘑多糖的提取、纯化及体外降血脂研究[D].哈尔滨市: 东北农业大学, 2017.
Chao CHEN. Extraction Purification and Lowing Pllasma Cholesterol in Vitro of Polysaccharide from Armillaria Mellea[D].Harbin: Northeast Agricultural University, 2017.
[17]张俊霞. 连钱草多糖分离纯化、结构分析及生物活性初探[D].恩施: 湖北民族学院, 2017.
Junxia ZHANG. Isolation,Purification,Structural Analysis and Bioactivities of Polysaccharides from Glechoma longituba(Nakai)Kupr.[D].Enshi: Hubei Institute For Nationalities, 2017.
[18]刘雅欣, 贾鹏, 王虹, 等. 乙醇分级沉淀黄芪多糖免疫活性的评价[J].中成药, 2020, 42(10): 2729-2732.
LIU Yaxin, JIA Peng, WANG Hong, et.al. Evaluation of immune activity of Astragalus polysaccharide by ethanol fractional precipitation[J].Chinese Patent Medicine, 2020, 42(10): 2729-2732.
[19]文春玉, 徐明, 杨云礼, 等. 我国野生食用菌营养成分与价值评价研究进展[J].中国食用菌, 2021, 40(11): 1-10,20.
WEN Chunyu, XU Ming, YANG Yunli, et.al. Research Progress on Nutritional Components and Value Evaluation of Wild Edible Fungi in China[J].EDIBLE FUNGI OF CHINA, 2021, 40(11): 1-10,20.
[20]普布多吉, 王科, 马超, 等. 西藏牛肝菌物种资源概述[J].食用菌学报, 2018, 25(2): 137-165.
Pubuduoji, WANG Ke, MA Chao, et.al. Overview of bolus fungus species resources in Tibet[J].Journal of Edible Fungi, 2018, 25(2): 137-165.
[21]周强, 马德英, 林辰壹, 等. 新疆额尔齐斯河沿岸野生牛肝菌菌种的分离与鉴定[J].新疆农业科学, 2016, 53(1): 176-184.
ZHOU Qiang, MA Deying, LIN Chenyi, et.al. Isolation and identification of wild boletus strains along the Irtysh River in Xinjiang[J].Xinjiang Agricultural Sciences, 2016, 53(1): 176-184.
[22]马长中, 徐锦华, 张景荣, 等. 林芝橙黄疣柄牛肝菌营养成分分析与评价[J].食品与发酵工业, 2018, 44(5): 259-264.
MA Changzhong, XU Jinhua, ZHANG Jingrong, et.al. Analysis and evaluation of nutritional components of wild Leccinum aurantiacum(Bull.et Pers.)Gray from Linzhi[J].Food and Fermentation Industries, 2018, 44(5): 259-264.
[23]刘秋鸣, 李笑, 肖俊江, 等. 云南产黄皮疣柄牛肝菌基本营养成分和抗氧化活性[J].食品工业科技, 2018, 39(16): 275-280.
LIU Qiuming, LI Xiao, XIAO Junjiang, et.al. Nutritional Components and Antioxidant Activities of
Leccinum crocipodium in Yunnan[J].Food Industry Science and Technology, 2018, 39(16): 275-280.
[24]张春霞, 纪开萍, 何明霞, 等. 暗褐网柄牛肝菌子实体营养成分分析[J].云南大学学报(自然科学版), 2010, 32(6): 702-704.
ZHANG Chunxia, JI Kaiping, HE Mingxia, et.al. Analysis of nutritional constituents in the fruiting bodies of Phlebopus portentosus[J].Journal of Yunnan University, 2010, 32(6): 702-704.
[25]邓雅元, 游金坤, 华蓉, 等. 3种常见野生牛肝菌和3种大宗人工食用菌营养成分分析[J].中国食用菌, 2022, 41(3): 45-48.
DENG Yayuan, YOU Jinkun, HUA Rong, et.al. Nutritional Analysis of Three Common Wild Boltus spp.and Three
Staple Artificial Edible Fungi[J].Edlble Fungi Of China, 2022, 41(3): 45-48.
[26]董芳. 皱盖疣柄牛肝菌多糖结构分析及生物活性研究[D].广州: 华南理工大学, 2018.
Fang DONG. Study on Structure and Bioactivities of Polysaccarides from Leccinum rugosiceps[D].Guangzhou: South China University of Technology, 2018.
[27]伍燕, 徐峰, 李小双, 等. 皱盖疣柄牛肝菌多糖LRP-I和LRP-II结构表征及抗氧化活性分析[J].食品工业科技, 2020, 41(21): 8-14.
WU Yan, XU Feng, LI Xiaoshuang, et.al. Structural Elucidation and Antioxidant Activity of LRP-I and LRP-II Polysaccharide from Leccinum rugosiceps[J].Food Industry Science and Technology, 2020, 41(21): 8-14.
Determination of nutrient components and structural analysis of polysaccharides from wild Boletus ZHANG Xinyu1,2, Munire Mutalifu1,2 , YE Yijie1,2, FENG Qian1,2,3, ZHANG Zhidong2
(1. College of Food Science and Pharmacy, Xinjiang Agricultural University, Urumqi 830052, China;2. Institute of Microbiology, Xinjiang Academy of Agricultural Sciences/Xinjiang Key Laboratory of Special Environmental Microbiology, Urumqi 830091, China;3. Food Safety Testing Center of Aksu Region, Aksu Xinjiang 843000, China)
Abstract:【Objective】 In order to grasp the taxonomic status of Aksu wild Boletus, clarify its nutritional composition and analyze the main polysaccharide functional structure.【Methods】 Using morphological and molecular biology methods to identify wild Boletus, analyze the nutritional components and minerals in Boletus for detection. The crude polysaccharide of Boletus pumila was extracted using water extraction and alcohol precipitation method, and purified using DEAE-52 cellulose column chromatography. Then, its monosaccharide composition was analyzed using high-pressure hydraulic chromatography.【Results】 The wild Boletus from Aksu belongs to the order Agaricularia, family Boletus, and genus Boletus, and is identified by molecular identification as Leccinum duriusculum. Its main nutrients are sugars and proteins, accounting for 57.57% and 27.32% respectively. Three polysaccharide components were obtained through column chromatography combined with medium pressure chromatography system separation: LD-1, LD-2, and LD-3. Among them, LD-1 had the highest extraction rate of 78.8% and had strong water solubility. Infrared spectroscopy showed that it contained carbohydrate compounds with the highest proportion of glucose. 【Conclusion】 Wild Boletus in Aksu region is rich in polysaccharides and has strong water holding capacity. This result can provide scientific reference for the in-depth development and utilization of wild Boletus polysaccharides.
Key words:Boletus; nutrient composition; mineral elements; polysaccharide; isolation and purification
Fund projects:Sub-project of the third comprehensive scientific investigation in Xinjiang (2022xjkk1200); The Project of Fund for Stable Support to Agricultural Sci-Tech Renovation(xjnkywdzc-2023005-6); Agricultural Science and Technology Innovation Platform Capacity Improvement Project of Xinjiang Academy of Agricultural Sciences (nkypt005); Agricultural Sciences Independent Cultivation Project Team Construction Project of Xinjiang Academy of Agricultural Sciences (nkyzztd-001)
Correspondence author:ZHANG Zhidong (1977-), male, from Xinjiang, researcher, Ph.D.,masters supervisor,research direction: Special environmental microorganisms and probiotic resources, (E-mail) zhangzheedong@sohu.com
